据世界卫生组织(WHO)统计,全世界超过5%的人口,即 4.66亿人 患有致残性听力障碍,其中3400万是儿童。但目前临床上,对于遗传性耳聋,除了佩戴助听器和植入人工耳蜗,还没有任何有效的药物治疗手段。
基因测序技术的进步,为遗传性耳聋的诊断和治疗带来了新的曙光。目前已经发现了超过120个基因与遗传性耳聋相关,因此,通过基因测序确定耳聋的具体致病基因突变,可为疾病的确诊和后续的精准治疗奠定基础。
全基因组测序鉴定出常染色体显性遗传性耳聋的新型拷贝数变异缺失
遗传性耳聋 有多种模式,包括常染色体显性遗传、常染色体隐性遗传、X连锁遗传和线粒体遗传。其中, 常染色体显性遗传性耳聋(ADNSHL)具有高遗传、临床异质性以及发病延迟等特征,因此在新生儿听力筛查过程中很容易被忽略。目前已经发现了51个基因和67个不同位点与ADNSHL 相关。
迄今为止,研究发现世界范围内超过50个种族群体的 EYA4 基因变异与耳聋相关。 EYA4 基因变异引起的听力损失进展率约为5.75 dB/年,相对于 ADNSHL 患者的 POU4F3 和 MYO6 基因突变更为严重。
2022年5月16日,复旦大学附属眼耳鼻喉科医院耳科的 杨娟梅 和 袁雅生 团队在 BMC Medical
Genomics 期刊上发表了题为:Identification of a novel CNV at the EYA4 gene
in a Chinese family with autosomal dominant nonsyndromic hearing loss 的研究论文。

在该篇研究论文中,研究团队收集了一个患有ADNSHL 的中国四代家系,采用 华大智造自主研发的超高通量基因测序仪 DNBSEQ-T7 对从患者血液获取的基因组 DNA 进行高通量测序处理。
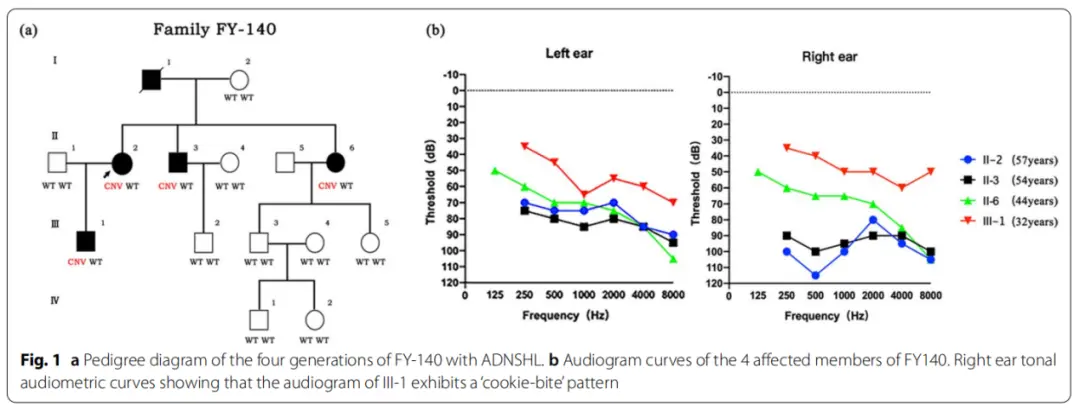
该中国家庭的四代遗传谱系图
通过生物信息学数据分析,研究团队在编码区域内含子上平均鉴定出 3585580 个单核苷酸多态性(SNPs)和732397个插入和缺失(indels),筛选预测得到的候选变异有 64个。通过全基因组测序(WGS)、靶向测序(TNGS)、Sanger 测序和共分离分析,研究团队锁定了在 EYA4 基因上可能导致 ADNSHL 的新型 拷贝数变异(CNV)缺失,其插入量为 10 bp,并与 ADNSHL 表型分离。
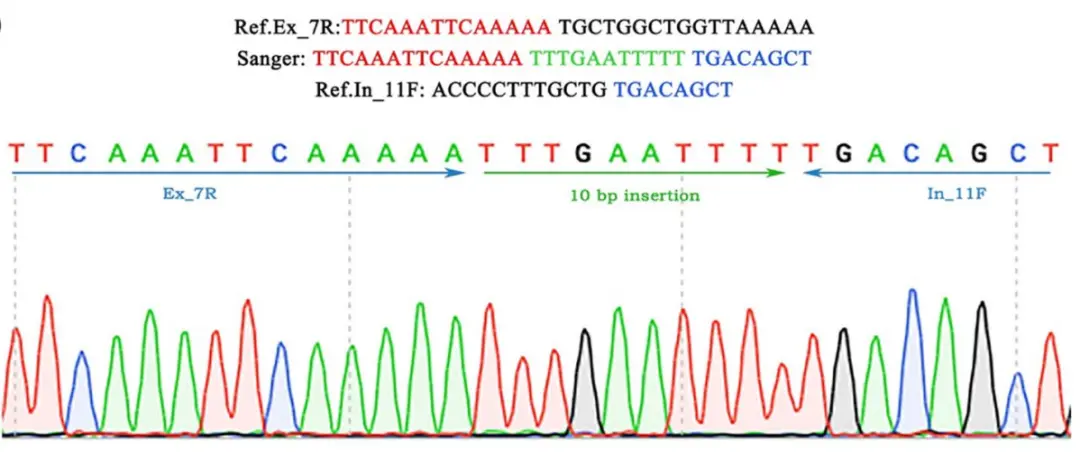
Sanger测序覆盖两个断点和一个10bp的插入
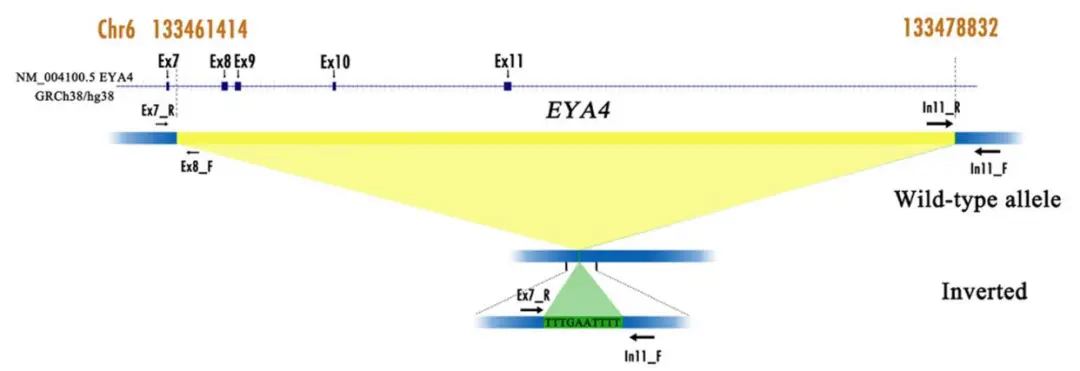
全基因组测序锁定EYA4基因8-11号外显子6q23区域的新型CNV缺失
研究人员推测,在该汉族人家庭中发现的这个新型 CNV会影响 EYA4 基因所编码蛋白的 eyaHR 结构域。eyaHR 高度保守的 C 末端区域通过与六个 DACH 蛋白家族成员在一个保守网络中相互作用 ,调节胚胎发育和柯蒂氏器(声波感受器)的功能,调节钠钾泵和内耳机械感觉细胞的发育。因此, 该 CNV 缺失很可能是通过影响患者内耳关键感觉细胞的发育,从而导致耳聋。
研究人员同时发现,该家系表型与先前报道的 EYA4 变异 CNV 缺失家系不同,同一家族团队有相同变异的个体间表型也不同。
这一发现扩展了中国汉族人群 EYA4 基因与 ADNSHL 间的基因型-表型相关性,并证实全基因组测序是一种准确、有效的 CNV 基因组特征验证方法。
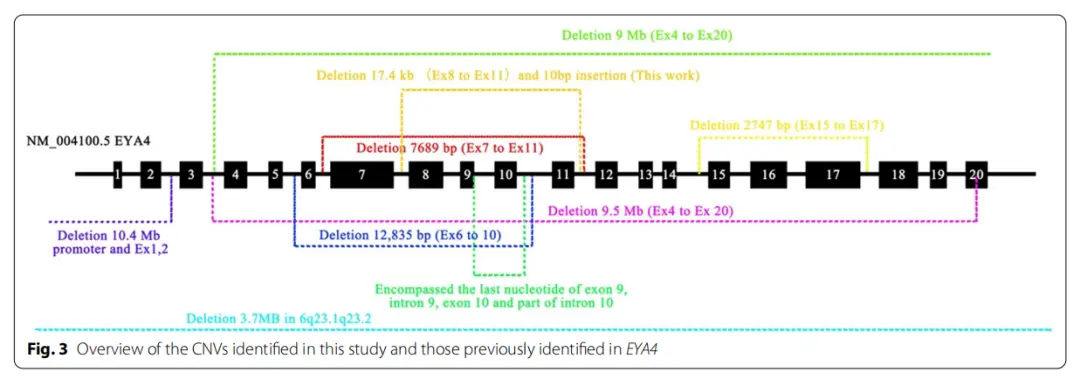
该研究中鉴定的新型CNV和之前在EYA4中发现的CNVs
参考文献:
[1] Zhang, W., Song, J.,Tong, B. et al.
Identification of a novel CNV at the EYA4 gene in a Chinesefamily with
autosomal dominant nonsyndromic hearing loss. BMC Med Genomics 15,113 (2022).
https://doi.org/10.1186/s12920-022-01269-x
[2] 基因慧:华西医院袁慧军教授:基于基因大数据的罕见病精准诊治研究。
https://mp.weixin.qq.com/s/nRYCpe7qsV6dM3oBJmfJfA
授权说明
本文转载自微信公众号:生物世界,如需转载请联系原公号。本文为听力行业通讯经授权转载,转载目的在于传递更多信息,并不代表听力行业通讯赞同其观点和对其真实性负责。
版权声明
转载文章所包含的文字和图片来源于原公号。如因作品内容、版权等存在问题,请于本文刊发30日内联系听力行业通讯进行删除。
「行业报告」
「案例沙龙」
「小儿听力学」
「临床听力师」
「技术论坛」
论坛资讯、 论坛回顾
「合作联系」